ВВЕДЕНИЕ
Баланопостит – это заболевание, поражающее дистальный кожный покров полового члена и вызывающее воспаление этих зон: крайней плоти и головки полового члена. Для баланопостита характерны отек мягких тканей, гиперемия и болезненность. Также возможно отхождение гнойного отделяемого из препуциального пространства. Баланопостит остается одной из наиболее частых урологических проблем у детей в возрасте 4-12 лет, составляя до 70% всей урологической патологии в данной возрастной группе [1-2].
В педиатрической популяции было проведено несколько исследований, посвященных распространенности воспаления полового члена различных типов. Результаты противоречат друг другу в отношении частоты возникновения воспаления полового члена у необрезанных или обрезанных детей. Также, сложно выявить точную статистику заболеваемости ввиду самостоятельного лечения баланопостита родителями без обращения к специалистам. Однако, ранее проведенные Д.И. Тарусиным и М.Г. Омаровым исследования показывают, что заболевания крайней плоти полового члена в младшей возрастной группе могут достигать распространенности более 25% (каждый 4 мальчик на профилактическом осмотре).
Этиологическая структура заболевания крайне разнообразна. Условно все формы можно разделить на несколько основных групп: инфекционные (кандидозный, бактериальный, баланопостит, вызванный инфекциями передающимися половым путем (ИППП), неинфекционные (контактный, экзематозный, склерозирующий лихен), дерматозы (псориаз, красный плоский лишай). Кроме того, баланопостит может носить неинфекционный характер. Катаральные формы баланопостита являются самыми распространенными [3–4].
Консервативное лечение баланопостита у детей сводится к местному лечению. В препуциальное пространство вводятся антибактериальные мази, чаще всего не содержащие глюкокортикостероидные гормоны, проводятся ванночки и санации с антисептическими растворами. Помимо этого, появляются новые многокомпонентные препараты, такие как Баланекс® Кидс, в состав которого входит ментронидазол, хлоргексидин и растительные экстракты (Софора желтоватая, Тимьян обыкновенный, эпигаллокатехин-3-галлат из экстракта зеленого чая).
С целью научного обоснования клинической эффективности крем-геля Баланекс® Кидс и его сравнения со стандартной терапией при различных формах баланопостита у детей нами было проведено соответствующее исследование с оценкой клинических показателей и нормализации микробиоты препуциального мешка.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было спланировано как открытое проспективное рандомизированное сравнительное. Всего в исследование было включено 20 детей в возрасте от 4 до 12 лет, которые были разделены на 4 группы в зависимости от характера и течения заболевания:
- Группа 1: Контрольная группа (здоровые дети) – для оценки нормальной микрофлоры препуциального мешка (n=5).
- Группа 2: Острый гнойный баланопостит (n=5).
- Группа 3: Острый катаральный баланопостит (n=5).
- Группа 4: Хронический баланопостит (n=5).
Критериями включения в исследование являлись: возраст от 4 до 12 лет, отсутствие сопутствующих заболеваний (сахарный диабет, иммунодефицитные состояния, дефицит витаминов), информированное согласие родителей/законных представителей. Внутри групп 2, 3 и 4 пациенты были рандомизированы в отношении применяемой схемы лечения: 3 пациента получали Баланекс® Кидс, 2 пациента получали традиционную терапию: санация препуциального мешка 0,05% водным раствором хлоргексидина + местное комбинированное средство (диоксометилтетрагидропиримидин + хлорамфеникол).
С целью оценки эффективности терапии применялся комплекс клинических и лабораторных методов исследования. Динамику клинической картины оценивали по 4-балльной шкале (от 0 до 3), отдельно по пяти категориям (краснота (гиперемия), болезненность при пальпации, болезненность при мочеиспускании, выделения гнойного содержимого, общая оценка воспаления). Микробиологическое исследование было проведено путем анализ микробиоты препуциального мешка методом хроматомасс-спектрометрии микробных маркеров (МСММ) по Осипову с оценкой: симбиотической микрофлоры (Lactobacillus spp., Bifidobacterium spp.), условно-патогенной микрофлоры (Enterococcus faecalis, Staphylococcus aureus, Streptococcus spp., E. coli), анаэробной микрофлоры (Bacteroides fragilis, Peptostreptococcus anaerobius), грибковой микрофлоры (Candida spp., Aspergillus spp.). Также нами применялся индекс дисбиоза препуциального мешка: отношение патогенной микрофлоры к полезной микрофлоре, характеризующий степень нарушения микроэкологического баланса. Оценка эффективности проводилась до начала лечения и на 7-е сутки терапии.
РЕЗУЛЬТАТЫ
На основании микробиологического обследования контрольной группы были сформированы референсные показатели нормальной микробиоты препуциального мешка. Среди ключевых характеристик здоровой микробиоты можно выделить: доминирование лактобацилл и бифидобактерий (63% от общей нагрузки), присутствие нормальной кожной флоры (Propionibacterium, Corynebacterium), минимальные количества условно-патогенной флоры (<3%) и богатое видовое разнообразие (8-12 видов микроорганизмов). Самая существенная роль в поддержании нормальной микрофлоры принадлежит лактобактериям и бифидобактериям (63,1%) (рис. 1, табл. 1).
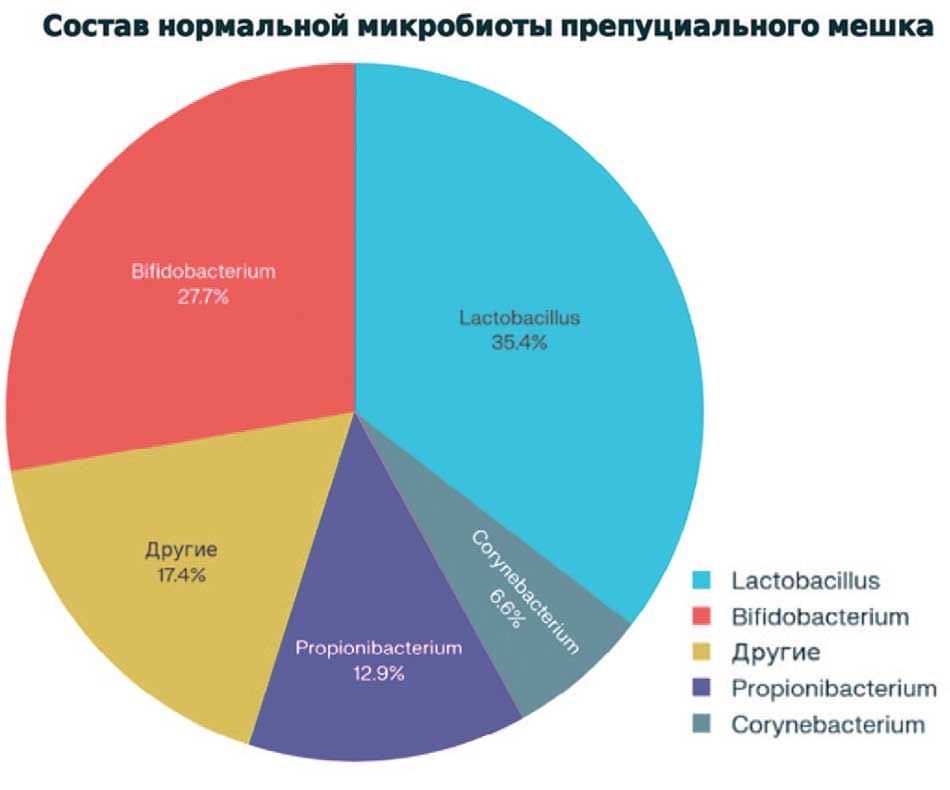
Рис. 1. Диаграмма нормальной микрофлоры препуция по данным исследования
Fig.1. Diagram of the normal microflora of the prepuce according to the data study
Клиническая оценка
Динамика клинического улучшения существенно различалась между всеми исследуемыми группами. Так, при остром гнойном баланопостите традиционное лечение показало более выраженную положительную динамику. Средняя разница при применении Баланекс® Кидс и традиционного лечения составила 8,3 (60-85% от исходных значений) и 10,5 баллов (83-92% от исходных значений) соответственно (рис. 2).
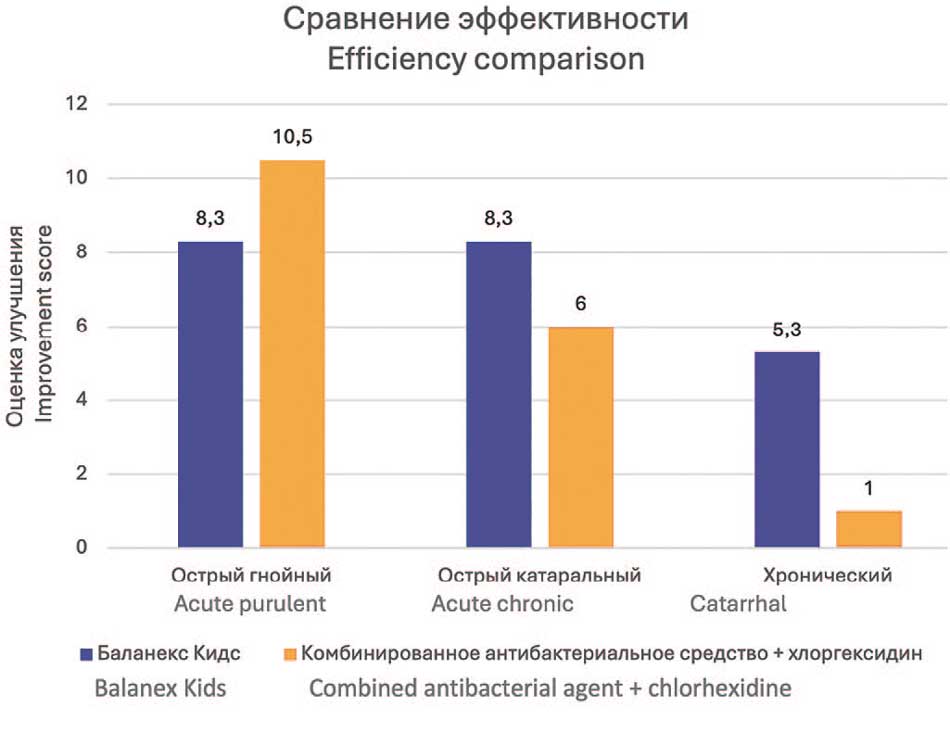
Рис. 2. Сравнение эффективности традиционной и опытной схем лечения различных типов препуциального дисбиоза
Fig. 2. Comparison of the effectiveness of traditional and experimental treatment regimens for various types of prepucial dysbiosis
При остром катаральном баланопостите ситуация была противоположной. Баланекс® Кидс превзошел по эффективности контрольное лечение. Средняя разница при применении Баланекс® Кидс составила 8,3 балла (89-100% от исходных значений) и традиционного лечения 6,0 баллов (56-78% от исходных значений) соответственно. Клиническое превосходство Баланекс® Кидса составило +2,3 балла (38% больше улучшений).
При хроническом баланопостите применение крем-геля «Баланекс® Кидс» привело к среднему клиническому улучшению на 5,3 балла (57-86% от исходных значений), а стандартной терапии всего на 1,0 балл (20-25% от исходных значений). При хроническом баланопостите Баланекс® Кидс показал выраженное превосходство над стандартным лечением (Δ=4,3 балла).
Таблица 1. Референсные показатели нормальной микробиоты препуциального мешка
Table 1. Reference indicators of the normal microbiota of the penile sheath
| Показатель Indicator | Средние значения, усл.ед. Average values, CU | Разброс (min-max) Variation (min-max) |
|---|---|---|
| Lactobacillus spp | 2143±25 | 2126-2187 |
| Bifidobacterium spp | 1678±35 | 1648-1734 |
| Общая симбиотическая флора Common symbiotic flora | 3821±42 | 3774-3866 |
| Общая микробная нагрузка Total microbial load | 6048±845 | 5439-7460 |
Микробиологическая оценка
При остром гнойном баланопостите у пациентов, находящихся на лечении Баланекс® Кидс и на стандартной терапии отмечалось уменьшение микробной нагрузки на 50,2% и 65,4%, соответственно. При остром катаральном баланопостите снижение микробной нагрузки составило -36,1% и -34,4%, в группе Баланекс® Кидс и при стандартной терапии, соответственно. При хроническом баланопостите общее снижение микробной нагрузки составило 30,4% в группе, получавшей Баланекс® Кидс, и – 42,5% в группе стандартной терапии (табл. 2).
С микробиологической точки зрения при остром гнойном баланопостите комбинация диоксометилтетрагидропиримидин + хлорамфеникол + санация хлоргексидином показала свое превосходство перед крем-гелем Баланекс® Кидс в виде более эффективной элиминации основных патогенов. Обе схемы лечения способны элиминировать кишечную палочку на 100%, однако, для золотистого стафилококка, стрептококка и энтерококка традиционная схема более эффективна.
При остром катаральном баланопостите Баланекс® Кидс показал на 67% более эффективную элиминацию грибковой флоры, а также в 2,3 раза более эффективное восстановление нормальной микробиоты. При хроническом баланопостите только Баланекс® Кидс показал уникальную способность сохранения и восстановления бактерий рода Bifidobacterium, а также был в 2 раза более эффективным в отношении анаэробов по сравнению со стандартной терапией (рис. 3, 4).
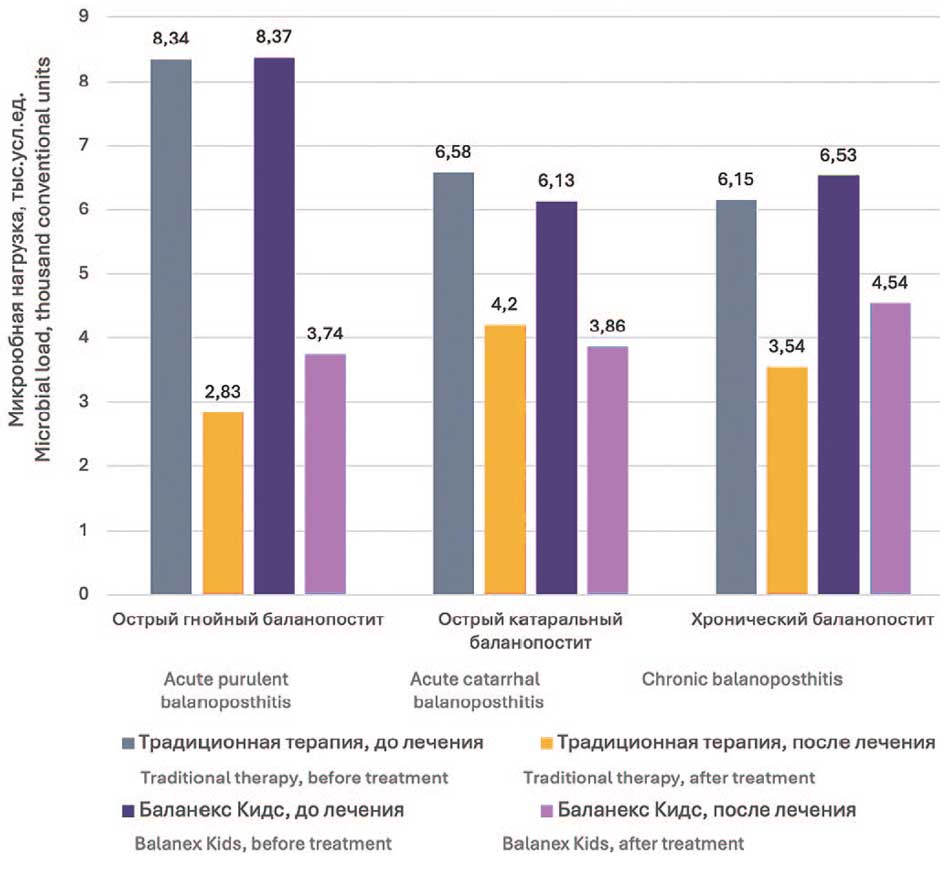
Рис. 3. Динамика общей микробной нагрузки в полости препуциального мешка при использовании традиционной и опытной схем лечения
Fig. 3. Dynamics of the total microbial load in the cavity of the preputial sac when using traditional and experimental treatment regimens
Таблица 2. Сравнительная эффективность разных схем лечения при различных формах баланопостита
Table 2. Comparative effectiveness of different treatment regimens for various forms of balanoposthitis
| Микроорганизм Microorganism | Острый гнойный баланопостит Acute purulent balanoposthitis | Острый катаральный баланопостит Acute catarrhal balanoposthitis | Хронический баланопостит Chronic balanoposthitis | |||
|---|---|---|---|---|---|---|
| Баланекс® Кидс Balanex® Kids | Комб. ср-во + Хлор-н Comb. Drug + Chlorx-ne | Баланекс® Кидс Balanex® Kids | Комб. ср-во + Хлор-н Comb. Drug + Chlorx-ne | Баланекс® Кидс Balanex® Kids | Комб. ср-во + Хлор-н Comb. Drug + Chlorx-ne | |
| Lactobacillus | +111,5% (10-120%) | +168,0% (165-171%) | +128,1% (126-130%) | +55,9% (52-60%) | +191,4% (174-209%) | +57,0% (45-69%) |
| Bifidobacterium | +74,9% (72–78%) | -100% у обоих пациентов | ||||
| Staphylococcus aureus | -55,8% (50-61%) | -78,5% (77-80%) | ||||
| Streptococcus spp | -57,3% (48-65%) | -78,1% (76-80%) | ||||
| Candida spp | -88,7% (87-90%) | -53,1% (51-55%) | ||||
| Элиминация анаэробов Elimination of anaerobes (Bacteroides, Peptostreptococcus) | >89% | 40-45% | ||||
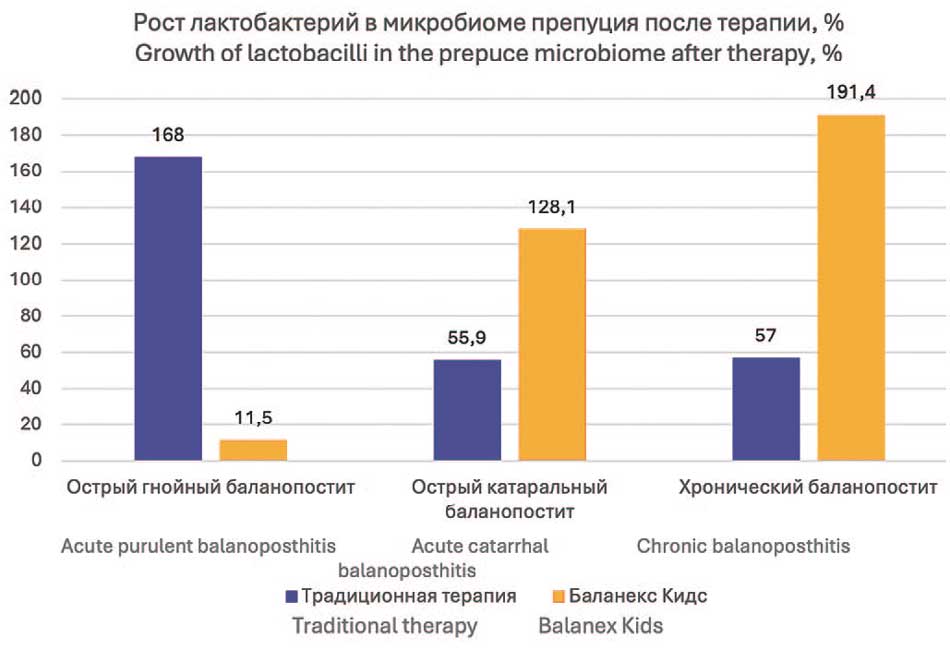
Рис. 4. Сравнительная эффективность использовании традиционной и опытной схем лечения при оценке восстановления нормального микробиома препуция
Fig. 4. Comparative effectiveness of using traditional and experimental treatment regimens in assessing the restoration of the normal microbiome of the prepuce
ОБСУЖДЕНИЕ
При всей кажущейся простоте и рутинном характере заболевания, баланопостит представляет собой многогранную проблему, требующую индивидуального подхода к каждому пациенту, особенно в детском возрасте. Для выработки оптимальных алгоритмов лечения нами была сформулирована концепцию дисбиоза препуциального мешка. Под этим мы понимаем нарушение микроэкологического баланса препуциального мешка, характеризующееся количественными и качественными изменениями в составе микробиоты. Часть этих изменений протекает скрыто в форме хронического баланита, постита, баланопостита. Часть – в форме катарального воспаления, при котором жалобы или не слишком выражены, или не так многочисленны. Главной жалобой является гиперемия (покраснение крайней плоти), боль как феномен появляется и проявляется не у всех пациентов. Часть изменений протекает в форме критического воспаления – острого гнойновоспалительного процесса, который инициирует быстрое обращение к специалисту.
Дисбиоз препуциального мешка можно разделить на несколько типов.
I. Острый гнойный дисбиоз (баланит, постит, баланопостит):
Доминирующие патогены: Staphylococcus aureus, Streptococcus spp, E. coli.
Механизм: массивная бактериальная инвазия с подавлением нормальной флоры.
Терапия выбора: антибактериальные препараты.
II. Катаральный дисбиоз (баланит, постит, баланопостит):
Доминирующие патогены: Candida spp, Streptococcus spp.
Механизм: грибково-бактериальная ассоциация.
Терапия выбора: комбинированные препараты (Баланекс® Кидс).
III. Хронический анаэробный дисбиоз (баланит, постит, баланопостит):
Доминирующие патогены: Bacteroides fragilis, Peptostreptococcus spp.
Механизм: анаэробная селекция в условиях стаза.
Терапия выбора: антианаэробные препараты (Баланекс® Кидс).
Схема лечения с использованием комбинации антибактериального местного средства + хлоргексидина обладает рядом преимуществ. Однако, при этом у данной схемы есть и ограничения, такие как слабая активность против анаэробных микроорганизмов, недостаточное противогрибковое действие, сопутствующее уничтожение симбиотической микрофлоры (особенно бифидобактерий) и ограниченная эффективность при хронических формах.
В тоже время у исследуемого средства «Баланекс® Кидс» отмечается ряд преимуществ. Наличие метронидазола – противомикробного и противопротозойного агента – позволяет оказывать комплексное действие против анаэробных микроорганизмов. Метронидазол проникает в бактериальную клетку, восстанавливает собственную нитрогруппу и оказывает цитотоксический эффект [5].
Активность крем-геля «Баланекс® Кидс» при наличии отделяемого сохраняется благодаря хлоргексидину. Хлоргексидин действует на клеточную мембрану, повышая ее проницаемость. Основа бактерицидного действия хлоргексидина заключается в быстрой адсорбции на микробной стенке и на кристаллизации мембраны, что приводит к потере ее структурной деятельности и дальнейшей гибели клетки [6–7].
Растительные экстракты в составе Баланекса® Кидс обеспечивают антимикробное, противогрибковое и противовоспалительное действие геля. Флавоноиды, содержащиеся в экстракте корней Софоры желтоватой, проявляют значительную антимикробную, бактериостатическую и противогрибковую активность, а также снижают тяжесть воспалительных процессов за счет подавления экспрессии провоспалительных цитокинов, снижения выработки активных форм кислорода. Экстракт Тимьяна, согласно результатам исследования, обладает сильными противомикробными свойствами в отношении часто встречающихся возбудителей (Staphylococcus aureus, Pseudomonas aeruginosa, Salmonella typhimurium, Escherichia coli, Klebsiella pneumoniae, Enterococcus faecalis и Candida albicans) и оказывает противозудный и обезболивающий эффекты. Экстракт зеленого чая известен своими антибактериальными и противовоспалительными свойствами. Эпигаллокатехин-3-галлат, один из катехинов зеленого чая, оказывает противовоспалительный эффект за счет антиоксидантных свойств, обладает противовирусной активностью с различными механизмами действия на различных семействах вирусов, таких как Retroviridae, Orthomyxoviridae и Flaviviridae, оказывает антибактериальное действие против стафилококков, включая бактерицидную активность, синергизм в сочетании с другими антибиотиками, активность против биопленки и ингибирование продукции β-лактамазы или нейтрализацию высвобождаемых токсинов, обладает противогрибковой активностью в отношении грибов рода Candida [8-18].
В отличие от стандартной терапии применение Баланекса® Кидс способствовало сохранению, восстановлению и поддержке полезной микрофлоры. Среди недостатков данного крем-геля можно отметить умеренную активность против стафилококков при остром гнойном процессе и более медленное начальное действие при тяжелом воспалении. При умеренной гиперемии, катаральных выделениях, наличии грибковой флоры можно заподозрить острый катаральный баланопостит, при котором рекомендуется применять крем-гель «Баланекс® Кидс» в течение 7-10 дней, ориентировочная клиническая эффективность подобной схемы 89-100%.
При этом необходимо проводить контроль эффективности, которые можно разделить на несколько уровней: клинический контроль (оценка через 3-5 дней лечения), микробиологический (контроль через 1 неделю после окончания курса), и долгосрочный контроль (наблюдение 3-6 месяцев) для оценки рецидивов.
В данном исследовании нами была сформулирована валидированная концепция дисбиоза препуциального мешка с количественными критериями данного состояния, а также доказана дифференцированная эффективность различных схем лечения в зависимости от по нозологической формы. Широкий спектр примененных диагностических методик позволил нам с микробиологических позиций обосновать выбор той или иной терапии, а также выработать практические алгоритмы для педиатрической урологической практики.
Стало понятным, что богатое микробное разнообразие препуциального мешка, является основой здоровой микроэкосистемы. Дальнейшие исследования должны быт направлены на изучение долгосрочных эффектов различных схем лечения на микробиоту, разработку персонализированных схем терапии, исследование диагностических критериев и пробиотической коррекции дисбиоза препуциального мешка.
ОГРАНИЧЕНИЯ ИССЛЕДОВАНИЯ
В связи с тем, что количество пациентов в исследовании достаточно ограниченное, статистическая обработка включала методы непараметрической статистики для малых групп. Несмотря на достаточную достоверность выводов, следует продолжать исследование для достижения приемлемого для публикации данных результата. Так как воспалительные изменения препуциального мешка (баланопоститы, дисбиоз) не являются редким орфанным заболеванием, а, напротив, часто регистрируются у детей и подростков, строгие правила научного поиска и доказательной медицины требуют, как минимум, 13-15 человек в каждой из подгрупп.
ЗАКЛЮЧЕНИЕ
Данные проведенного исследования подтверждают дифференцированную эффективность препаратов. Баланекс® Кидс показал более высокую эффективность при катаральных и, особенно, при хронических формах. Микробиологические данные подтверждают клинические результаты. Полученные результаты обосновывают персонализированный подход к лечению баланопостита у детей с учетом нозологической формы и микробиологического статуса.
ЛИТЕРАТУРА
- Lincopan N, Neves P, Mamizuka EM, Levy CE. Balanoposthitis caused by Pseudomonas aeruginosa co-producing metallo-beta-lactamase and 16S rRNA methylase in children with hematological malignancies. Int J Infect Dis 2010;14(4):344-7. https://doi.org/10.1016/j.ijid.2009.04.016
- Morris BJ, Krieger JN. Penile Inflammatory Skin Disorders and the Preventive Role of Circumcision. Int J Prev Med 2017;8:32. https://doi.org/10.4103/ijpvm.IJPVM_377_16
- Shim TN, Ali I, Muneer A, Bunker CB. Benign male genital dermatoses. BMJ 2016;354:4337. https://doi.org/10.1136/bmj.i4337
- Васильев М.М., Гомберг М.А. Ковалык В.П. Абдумаликов Р.А., Белавин А.С. К вопросу патологии головки и крайней плоти полового члена. Инфекции передаваемые половым путем 2000;(4):35-6. [Vasiliev M.M., Gomberg M.A., Kovalyk V.P., Abdumalikov R.A., Belavin A.S. On the issue of examining the head and even the flesh of the penis. Infekcii peredavaemye polovym putem = Sexually Transmitted Infections 2000;(4):35-6 (In Russian)].
- Freeman CD, Klutman NE, Lamp KC. Metronidazole. A therapeutic review and update. Drugs 1997;54(5):679-708. https://doi.org/10.2165/00003495-199754050-00003
- McDonnell G, Russell AD. Antiseptics and disinfectants: activity, action, and resistance. Clin Microbiol Rev 1999;12(1):147-79. https://doi.org/10.1128/CMR.12.1.147
- Cheung HY, Wong MM, Cheung SH, Liang LY, Lam YW, Chiu SK. Differential actions of chlorhexidine on the cell wall of Bacillus subtilis and Escherichia coli. PLoS One 2012;7(5):36659. https://doi.org/10.1371/journal.pone.0036659
- Li JJ, Zhang X, Shen XC, Long QD, Xu CY, Tan CJ, Lin Y. Phytochemistry and biological properties of isoprenoid flavonoids from Sophora flavescens Ait. Fitoterapia 2020;143:104556. https://doi.org/10.1016/j.fitote.2020.104556
- Zhang L, Zhang H, Zhu Z, Jiang L, Lu X, Zhou M, et al. Matrine regulates immune functions to inhibit the proliferation of leukemic cells. Int J Clin Exp Med 2015;8(4):5591-600.
- Shao J, Wang T, Yan Y, Shi G, Cheng H, Wu D, et al. Matrine reduces yeast-to-hypha transition and resistance of a fluconazole-resistant strain of Candida albicans. J Appl Microbiol 2014;117(3):618-26. https://doi.org/10.1111/jam.12555
- Borugă O, Jianu C, Mişcă C, Goleţ I, Gruia AT, Horhat FG. Thymus vulgaris essential oil: chemical composition and antimicrobial activity. J Med Life 2014;7(3):56-60.
- Gupta D, Kamat S, Hugar S, Nanjannawar G, Kulkarni R. A comparative evaluation of the antibacterial efficacy of Thymus vulgaris, Salvadora persica, Acacia nilotica, Calendula arvensis, and 5% sodium hypochlorite against Enterococcus faecalis: An in-vitro study. J Conserv Dent 2020;23(1):97-101. https://doi.org/10.4103/JCD.JCD_48_20
- Patil SM, Ramu R, Shirahatti PS, Shivamallu C, Amachawadi RG. A systematic review on ethnopharmacology, phytochemistry and pharmacological aspects of Thymus vulgaris Linn. Heliyon 2021;7(5):07054. https://doi.org/10.1016/j.heliyon.2021.e07054
- Thitimuta S, Pithayanukul P, Nithitanakool S, Bavovada R, Leanpolchareanchai J, Saparpakorn P. Camellia sinensis L. Extract and Its Potential Beneficial Effects in Antioxidant, Anti-Inflammatory, Anti-Hepatotoxic, and Anti-Tyrosinase Activities. Molecules 2017;22(3):401. https://doi.org/10.3390/molecules22030401
- Khan I, Abbas T, Anjum K, Abbas SQ, Shagufta BI, Shah SAA, et al. Antimicrobial potential of aqueous extract of Camellia sinensis against representative microbes. Pak J Pharm Sci 2019;32(2):631-6.
- Ohishi T, Goto S, Monira P, Isemura M, Nakamura Y. Anti-inflammatory Action of Green Tea. Antiinflamm Antiallergy Agents Med Chem 2016;15(2):74-90. https://doi.org/10.2174/1871523015666160915154443
- Han Y. Synergic anticandidal effect of epigallocatechin-O-gallate combined with amphotericin B in a murine model of disseminated candidiasis and its anticandidal mechanism. Biol Pharm Bull 2007;30(9):1693-6. https://doi.org/10.1248/bpb.30.1693
- Steinmann J, Buer J, Pietschmann T, Steinmann E. Anti-infective properties of epigallocatechin-3-gallate (EGCG), a component of green tea. Br J Pharmacol 2013;168(5):1059-73. https://doi.org/10.1111/bph.12009




